トリプルネガティブ乳がんの悪性化に寄与する新たな因子を発見
2025.04.14 研究
- Fibronectin type III domain-containing protein 3A(FNDC3A)を高発現するトリプルネガティブ乳がん(TNBC)は予後不良である。
- FNDC3Aの発現を抑制するとTNBCの浸潤、幹細胞化といった悪性化が阻害される。
- FNDC3Aはがん細胞の増殖や器官形成に重要な転写因子Yes associated protein 1(YAP1)を介して、TNBCの悪性化を制御する。
本研究成果は、難治性がんであるTNBCに対する新たな治療標的としてFNDC3A-YAP1経路が有望であることを示したものであり、新しい治療薬の開発につながる可能性があります。
本件の概要
乳がんは、女性のがんのうち最も多いがんであり、わが国で年間9万人以上が罹患しています。乳がん全体の約20%を占めるトリプルネガティブ乳がん(TNBC)は、他の乳がんに比べて悪性度が高く浸潤・転移しやすいため、乳がんの中でも最も予後が不良です。TNBCには、明確な治療標的が見つかっていないため、TNBCが悪性化する分子メカニズムを明らかにし、新たな治療薬の開発につなげることが切望されています。
弘前大学大学院地域共創科学研究科修士課程2年の和田七華さん、同大学農学生命科学部(同大学院地域共創科学研究科兼任)の西塚誠准教授の研究グループは、浜松医科大学医学部、名古屋市立大学薬学部との共同研究により、TNBCの悪性化を促進する新しい因子としてFibronectin type III domain-containing protein 3A(FNDC3A)を同定しました。さらに、FNDC3Aはがん細胞の増殖や器官形成に重要な転写因子Yes associated protein 1(YAP1)の制御を介してTNBCの悪性化を促進することも明らかにしました。今回の成果は、これまで細胞機能が不明であったFNDC3Aの機能メカニズムの一端を明らかにしたとともに、難治性がんであるTNBCに対する新たな治療標的としてFNDC3A-YAP1経路が有望であることを示したものであり、TNBCの新たな治療薬開発に寄与することが期待されます。
本研究成果は、2025年3月24日(火)に国際科学誌 Biochimica et Biophysica Acta (BBA)- Molecular Cell Researchにオンライン掲載されました。
本件の詳細
研究の背景
乳がんは、女性に最も多くみられるがんであり、エストロゲン受容体、プロゲステロン受容体、human epidermal growth factor receptor 2(HER2)の発現の有無によって大きく4つに分類されます。トリプルネガティブ乳がん(TNBC)は、いずれの受容体も発現していないタイプで、全乳がん患者の約20%を占めます。エストロゲン受容体、プロゲステロン受容体、HER2のいずれかの受容体が発現しているタイプの場合、ホルモン療法や受容体を標的とした分子標的薬を用いた治療が可能ですが、すべての受容体を持たないTNBCには、有効な治療標的が存在せず、複数の化学療法剤を経験的に用いた治療が中心です。さらに、TNBCは増殖が速く、浸潤性および転移性が高いため、乳がんの中で最も予後が不良です。そのため、TNBCの特徴を分子レベルで解明し、TNBCの新たな治療標的となる分子を見つけることが重要な課題です。
Fibronectin type III domain-containing protein 3A(FNDC3A)は、タンパク質の相互作用に重要なプロリンリッチ領域、フィブロネクチンタイプIIIドメインを持ち、小胞体に局在するタンパク質として2006年に単離されました。乳がんとの関連性については報告されておらず、また機能メカニズムについてもよくわかっていませんでした。
研究成果
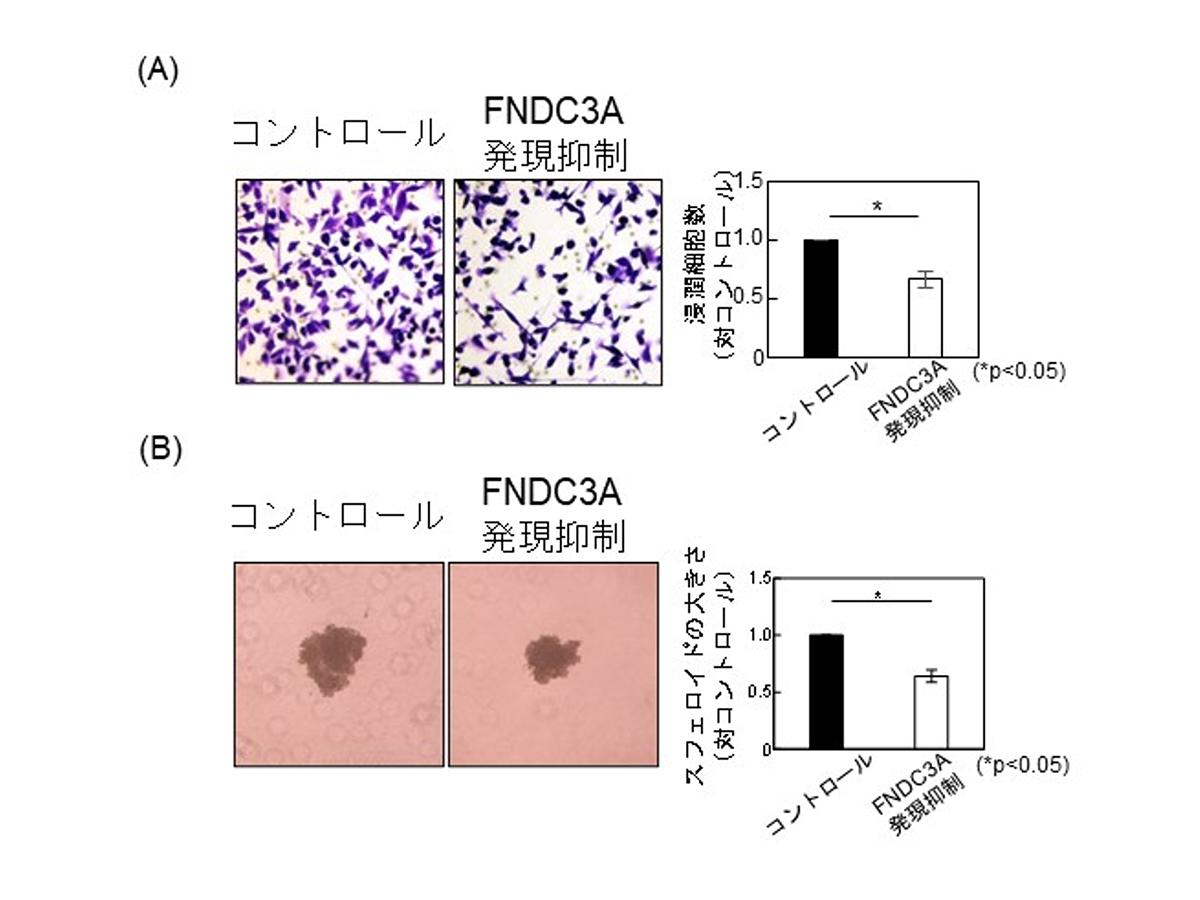
研究グループはまず、TNBCにおけるFNDC3A発現と予後との関係を調べるために、カプランマイヤー解析を実施しました。解析の結果、FNDC3A発現が高いTNBC乳癌患者は、FNDC3A発現が低い患者よりも有意に予後が悪いことが明らかになりました(図1)。そこで次に、FNDC3Aの発現抑制がTNBC細胞株の悪性化に与える影響を評価しました。その結果、FNDC3A発現抑制細胞では、悪性化の指標であり、がん細胞の転移に重要な浸潤能と増殖や薬剤耐性に寄与する幹細胞化がいずれも抑制されることがわかりました(図2)。
FNDC3Aがどのようなメカニズムで乳がん細胞の悪性化を促進するか明らかにするために、RNA Sequenceによる遺伝子発現解析を行いました。得られた因子の中で、がん細胞の増殖や器官形成に重要な役割を担うことが知られている、YAP1(Yes-associated Protein 1)に着目し、さらなる検討を行った結果、FNDC3A発現抑制細胞では、YAP1の発現とその標的遺伝子の発現がいずれも減少する結果が得られました(図3)。さらに、FNDC3A発現抑制細胞にYAP1の発現を戻すと、FNDC3A発現抑制により観察された浸潤能の阻害効果がキャンセルされることもわかりました(図4)。以上の結果から、FNDC3Aは新しいYAP1制御因子であり、YAP1を介して、TNBCの浸潤を亢進させることが示唆されました。
図1:FNDC3Aの発現が高いTNBC患者は予後不良である
図2:FNDC3Aの発現抑制はTNBCの悪性化を阻害する。(A) 浸潤能(紫色の細胞数) (B) 幹細胞化(スフェロイドの大きさ)。
図3:FNDC3A発現抑制は、YAP1とその標的遺伝子の発現を阻害する。BIRC5,CDK6,CYR61は、YAP1の標的遺伝子であり、YAP1によりその発現が制御される。
図4:YAP1の発現を戻すと、FNDC3Aの発現抑制により低下した浸潤能を回復させる。
今後の展開
本論文は、TNBCの悪性化においてFNDC3Aが重要な役割を果たすことを初めて明らかにしたものであり、TNBC悪性化の分子メカニズムの一端を解明しただけにとどまらず、TNBCに対する新たな治療標的としてFNDC3A-YAP1経路が有望であることを示しました。今後、FNDC3Aのより詳細な機能の解析が進むことにより、TNBCの新しい治療薬の開発につながることが期待されます。
論文情報
公表日:2025年3月24日(火)
詳細
プレスリリース本文は こちら(936KB)
プレスリリースに関するお問合せ先
農学生命科学部食料資源学科 准教授 西塚 誠 TEL:0172-39-3738
E-mail:nishizukahirosaki-u.ac.jp



